Les formes bénignes restent majoritaires, des thérapies ciblées sont en développement.
Le lupus érythémateux aigu systémique (LES, anciennement disséminé) est une pathologie auto-immune de mécanisme mal connu. L’expression la plus fréquente, cutanéo-articulaire, est d’évolution habituellement bénigne, mais des formes graves avec atteinte viscérale sévère sont possibles, obérant le pronostic fonctionnel ou vital. La maladie peut s’accompagner d’autres syndromes auto-immuns, qu’ils soient spécifiques d’organes comme la thyroïdite auto-immune, ou systémiques tel le syndrome des antiphospholipides (SAPL).
Il touche avec prédilection la femme en période d’activité génitale (sex-ratio de 9 femmes pour 1 homme). Il est habituellement plus sévère chez l’homme et dans la population antillaise.
Il touche avec prédilection la femme en période d’activité génitale (sex-ratio de 9 femmes pour 1 homme). Il est habituellement plus sévère chez l’homme et dans la population antillaise.
Pathogénie : complexe
Dans l’exploration des causes de la maladie, le séquençage moléculaire a révélé des anomalies de production des protéines lymphocytaires et des interférons, et des troubles des cytokines pro-inflammatoires.
La cascade pathogène débuterait par une réaction inadaptée des cellules dendritiques (qui présentent les antigènes au système immunitaire) en présence de résidus moléculaires de l’apoptose normale des cellules. Cela aboutirait à l’activation de lymphocytes B et C autoréactifs et à l’accumulation de complexes immuns (auto-anticorps et protéines cellulaires) dans les organes. Les anticorps antiphospholipides, particulièrement néfastes, s’attaquent aux vaisseaux (cellules endothéliales), entraînant une hypercoagulabilité responsable de thromboses.
Une prédisposition génétique existe, mais les mutations mono- géniques des protéines C2 ou C4 du complément par exemple, sont exceptionnelles. Les atteintes polygéniques constituent la majorité des observations chez l’adulte.
Des éléments extérieurs favorisent un LES ou ses poussées : exposition solaire, médicaments, stress, infection virale (EBV), hormones sexuelles (grossesse, prise d’estrogènes). Un terrain génétique favorable est considéré comme nécessaire pour qu’ils puissent déclencher la maladie.
Certains médicaments (encadré 1 ) provoquent des lupus induits, totalement régressifs à leur arrêt. Ils se caractérisent habituellement par des signes généraux, une atteinte séreuse, articulaire et cutanée et des anticorps anti-histones. Les formes rénales graves sont rares, comme la présence d’anticorps anti-ADN natifs.
La cascade pathogène débuterait par une réaction inadaptée des cellules dendritiques (qui présentent les antigènes au système immunitaire) en présence de résidus moléculaires de l’apoptose normale des cellules. Cela aboutirait à l’activation de lymphocytes B et C autoréactifs et à l’accumulation de complexes immuns (auto-anticorps et protéines cellulaires) dans les organes. Les anticorps antiphospholipides, particulièrement néfastes, s’attaquent aux vaisseaux (cellules endothéliales), entraînant une hypercoagulabilité responsable de thromboses.
Une prédisposition génétique existe, mais les mutations mono- géniques des protéines C2 ou C4 du complément par exemple, sont exceptionnelles. Les atteintes polygéniques constituent la majorité des observations chez l’adulte.
Des éléments extérieurs favorisent un LES ou ses poussées : exposition solaire, médicaments, stress, infection virale (EBV), hormones sexuelles (grossesse, prise d’estrogènes). Un terrain génétique favorable est considéré comme nécessaire pour qu’ils puissent déclencher la maladie.
Certains médicaments (
Clinique : polymorphe
Manifestations cutanées
Présentes dans 80 % des cas, elles sont fréquentes et typiques, mais très variées.
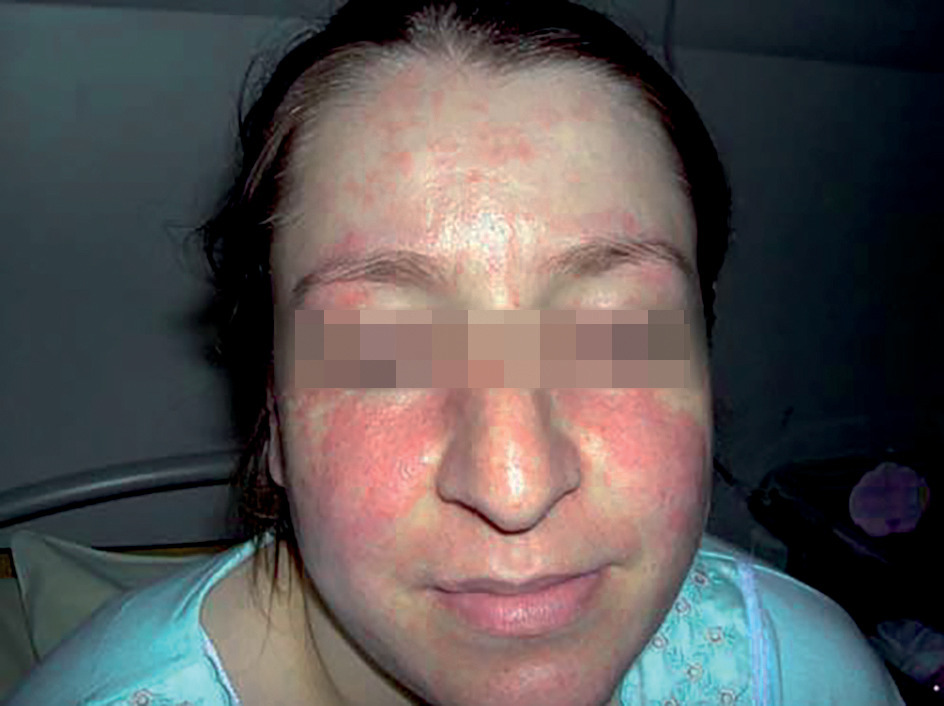
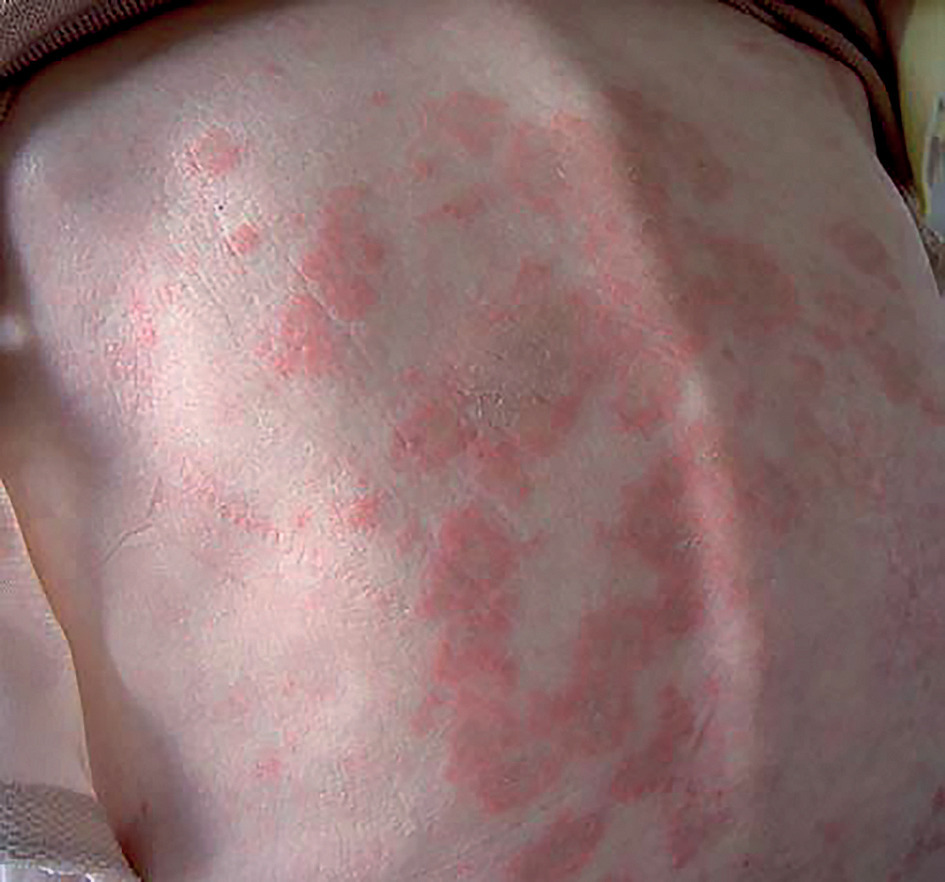
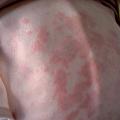
Trois types de lésions spécifiques sont décrits. Le lupus aigu est caractérisé par le vespertilio de topographie symétrique ou en ailes de papillon (fig. 1 ). Les lésions érythémateuses ou maculo- papuleuses, non prurigineuses, disparaissent sans séquelles. Dans la forme subaiguë, l’éruption siège aux zones photosensibles (fig. 2 ) ; annulaire ou polycyclique, elle est généralement associée à des anticorps anti-SSA (ou anti-Ro).
Le lupus chronique, le plus souvent discoïde, se manifeste par des plaques érythémateuses, des squames et une atrophie cicatricielle. Il siège au visage, aux oreilles, aux mains.
Livedo, phénomène de Raynaud, urticaire, purpura, ulcère de jambes sont parfois associés.
Trois types de lésions spécifiques sont décrits. Le lupus aigu est caractérisé par le vespertilio de topographie symétrique ou en ailes de papillon (
Le lupus chronique, le plus souvent discoïde, se manifeste par des plaques érythémateuses, des squames et une atrophie cicatricielle. Il siège au visage, aux oreilles, aux mains.
Livedo, phénomène de Raynaud, urticaire, purpura, ulcère de jambes sont parfois associés.
Manifestations articulaires
Fréquentes (80 % des cas), les arthralgies surviennent dans un tableau de polyarthrite symétrique touchant les petites articulations (MCP, IPP, carpe, genoux et chevilles). Mais, contrairement à la polyarthrite rhumatoïde, l’atteinte n’est pas déformante et rarement destructrice.
Manifestations neurologiques
Compliquant 30 à 60 % des LES, le « neurolupus » ne touche que rarement les neurones périphériques (neuropathies, multi- névrites, voire polyradiculonévrites). Les atteintes centrales sont plus fréquentes, plus graves et de pronostic sévère. Les accidents vasculaires sont plutôt associés à des anticorps antiphospholipides. Des crises comitiales de tous types sont possibles. Une pseudosclérose en plaques entraîne des démyélinisations encéphalique ou médullaire (myélite lupique). La maladie peut toucher les nerfs crâniens et surtout provoquer des épisodes neuropsychiatriques sévères (psychotique ou dépressif).
Le diagnostic est difficile dans ces derniers cas quand l’IRM cérébrale est normale. Les manifestations directement liées au lupus doivent être distinguées des complications de la corticothérapie ou d’une dépression liée à une maladie chronique. Une atteinte démyélinisante et neuropsychiatrique est considérée comme grave et péjorative.
Le diagnostic est difficile dans ces derniers cas quand l’IRM cérébrale est normale. Les manifestations directement liées au lupus doivent être distinguées des complications de la corticothérapie ou d’une dépression liée à une maladie chronique. Une atteinte démyélinisante et neuropsychiatrique est considérée comme grave et péjorative.
Manifestations rénales
D’importance pronostique majeure, elles sont systématiquement et régulièrement traquées par bandelette urinaire durant la vie du patient. Toute protéinurie, inexpliquée par ailleurs, de plus de 0,5 g/j impose la biopsie rénale.
La principale atteinte est glomérulaire, mais ce n’est pas la seule : il peut s’agir d’une néphropathie vasculaire (souvent associée à un SAPL) ou interstitielle.
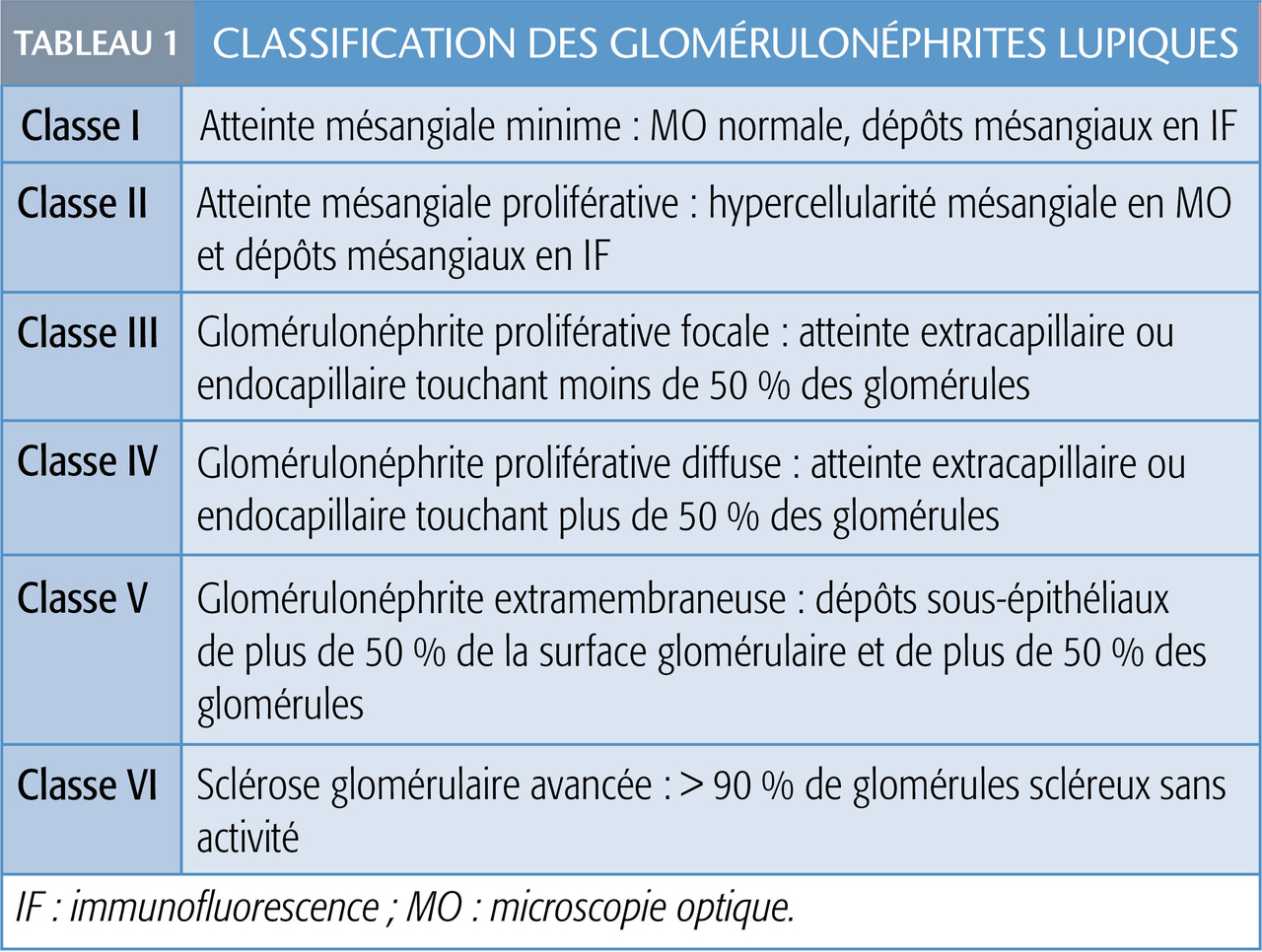
L’histologie est cruciale (tableau 1 ), elle détermine le pourcentage de lésions actives et séquellaires, la nécessité d’un traitement immunosuppresseur et le pronostic.
La principale atteinte est glomérulaire, mais ce n’est pas la seule : il peut s’agir d’une néphropathie vasculaire (souvent associée à un SAPL) ou interstitielle.
L’histologie est cruciale (
Manifestations cardiaques
Les 3 tuniques peuvent être touchées. La péricardite parfois latente est corticosensible. La myocardite est rare, sans signes spécifiques (insuffisance cardiaque, troubles du rythme ou conduction). Les lésions valvulaires (endocardite de Libman-Sacks) s’accompagnent d’anticorps antiphospholipides, avec les complications habituelles (greffe oslérienne, emboles artériels ou insuffisance cardiaque).
Manifestations pulmonaires
Une pleurésie, uni- ou bilatérale, lymphocytaire exsudative et corticosensible, est souvent associée à une péricardite, révélatrice ou latente. La tamponnade est exceptionnelle.
Pneumopathie interstitielle ou hypertension artérielle pulmonaire sont plus rares.
Pneumopathie interstitielle ou hypertension artérielle pulmonaire sont plus rares.
Autres éléments
Des signes généraux (fièvre, asthénie et/ou amaigrissement) isolés doivent inciter au bilan biologique rénal, immun (complément) qui fait le lien avec un LES.
L’analyse histologique d’adénopathies périphériques inexpliquées met en évidence une inflammation non spécifique : infiltrat lymphocytaire non tumoral, hyperplasie lymphocytaire réactionnelle ou aspect de maladie de Kikuchi.
L’analyse histologique d’adénopathies périphériques inexpliquées met en évidence une inflammation non spécifique : infiltrat lymphocytaire non tumoral, hyperplasie lymphocytaire réactionnelle ou aspect de maladie de Kikuchi.
Syndromes auto-immuns associés
Ils sont nombreux : connectivite (Gougerot-Sjögren), polyarthrite rhumatoïde (duo appelé rhupus) ou dermatomyosite. Les symptômes de plusieurs de ces pathologies peuvent s’assembler en connectivite mixte ou syndrome de Sharp.
Fréquent, le syndrome des antiphospholipides peut se manifester par : thromboses veineuses et/ou artérielles, complications obstétricales (fausses couches récurrentes précoces, morts fœtales in utero, prééclampsie ou prématurité en rapport avec une insuffisance placentaire). Il est caractérisé par des anticorps antiphospholipides persistant à au moins 12 semaines.
Parmi les atteintes d’organes, l’association à une thyroïdite auto-immune est l’une des plus courantes.
Fréquent, le syndrome des antiphospholipides peut se manifester par : thromboses veineuses et/ou artérielles, complications obstétricales (fausses couches récurrentes précoces, morts fœtales in utero, prééclampsie ou prématurité en rapport avec une insuffisance placentaire). Il est caractérisé par des anticorps antiphospholipides persistant à au moins 12 semaines.
Parmi les atteintes d’organes, l’association à une thyroïdite auto-immune est l’une des plus courantes.
Bilan biologique
Anomalies non spécifiques
Créatininémie élevée (insuffisance rénale), hypoalbuminémie, protéinurie, hématurie témoignent de l’atteinte rénale.
Il n’y a pas habituellement de syndrome inflammatoire au cours des poussées, sauf lors d’une atteinte séreuse ou de survenue d’une infection.
L’hémogramme peut révéler des cytopénies, le plus souvent auto-immunes (anémie hémolytique, thrombopénie immunologique, neutropénie auto-immune), mais d’autres causes sont possibles (carence en fer, micro-angiopathie thrombotique, syndrome d’activation macrophagique). Une lymphopénie est fréquente.
Un TCA allongé peut être dû à un anticoagulant circulant lupique.
Il n’y a pas habituellement de syndrome inflammatoire au cours des poussées, sauf lors d’une atteinte séreuse ou de survenue d’une infection.
L’hémogramme peut révéler des cytopénies, le plus souvent auto-immunes (anémie hémolytique, thrombopénie immunologique, neutropénie auto-immune), mais d’autres causes sont possibles (carence en fer, micro-angiopathie thrombotique, syndrome d’activation macrophagique). Une lymphopénie est fréquente.
Un TCA allongé peut être dû à un anticoagulant circulant lupique.
Stigmates immunologiques
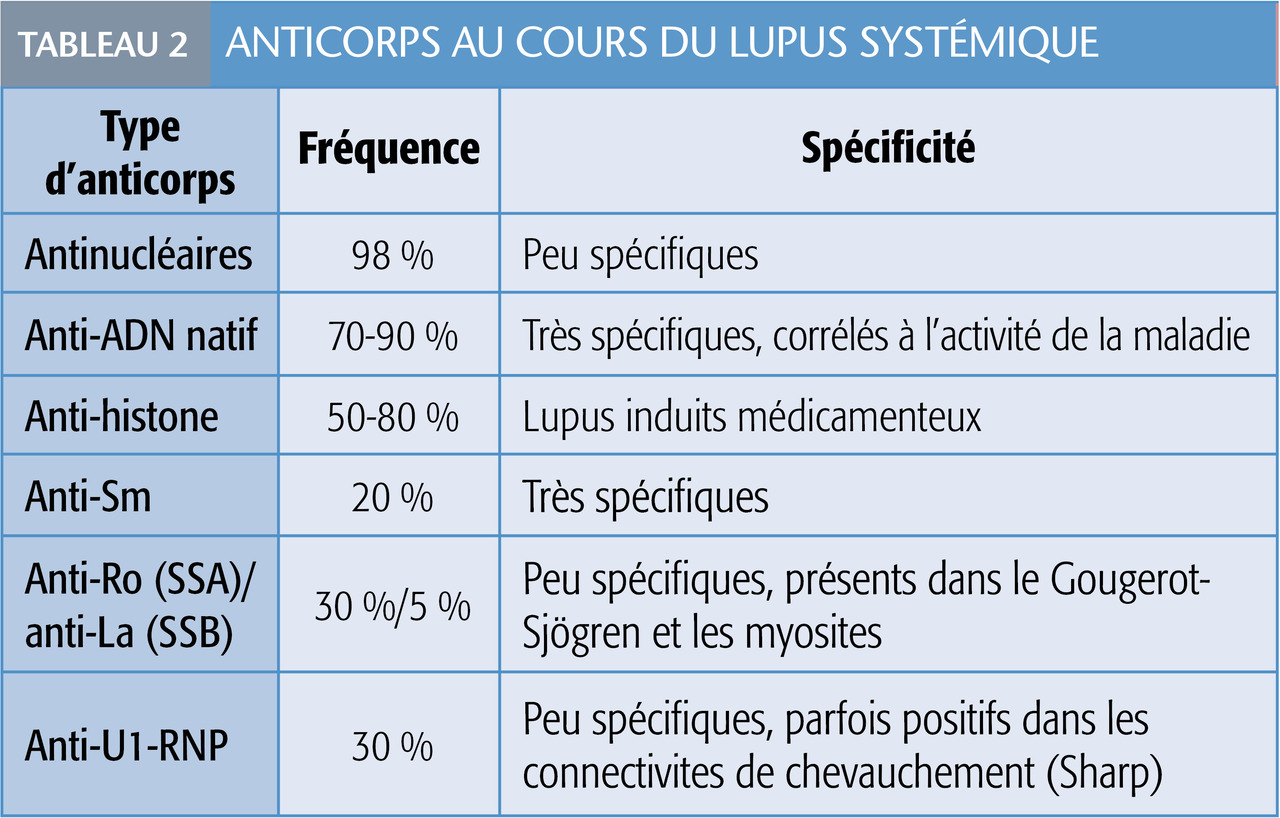
Les anticorps antinucléaires (présents dans plus de 95 % des cas) sont caractéristiques du lupus, mais on peut les trouver chez des sujets sains. En fluorescence, l’aspect homogène est le plus fréquent. Moucheté, il peut correspondre à des auto-anticorps spécifiques : anti-Sm, anti-RNP ou anti-SSA (tableau 2 ).
Les anticorps anti-ADN natifs reflètent l’activité de la maladie ; on les recherche par test ELISA ou test de Farr.
D’autres anticorps peuvent être présents, en particulier anti- thyroïdiens et antiphospholipides.
Lors des poussées lupiques, l’activation du complément se fait par la voie classique avec formation de complexes immuns ou via une cryoglobulinémie associée, avec baisse du CH50, C3 ou C4 très évocatrice. Une activation permanente fait suspecter un déficit génétique des protéines du complément (rare).
Les anticorps anti-ADN natifs reflètent l’activité de la maladie ; on les recherche par test ELISA ou test de Farr.
D’autres anticorps peuvent être présents, en particulier anti- thyroïdiens et antiphospholipides.
Lors des poussées lupiques, l’activation du complément se fait par la voie classique avec formation de complexes immuns ou via une cryoglobulinémie associée, avec baisse du CH50, C3 ou C4 très évocatrice. Une activation permanente fait suspecter un déficit génétique des protéines du complément (rare).
Diagnostic : difficile
L’expression de la maladie varie d’une personne à l’autre et au cours du temps pour un même patient : troubles cutanéo-articulaires, rénaux ou neuropsychiatriques, isolés ou associés. Une rechute peut toucher les mêmes organes que l’épisode inaugural ou d’autres.
Cette hétérogénéité rend le diagnostic difficile, surtout quand les signes sont peu spécifiques (arthralgies, atteintes séreuses ou neurologiques).
Certains doivent alerter : lésions cutanées évocatrices, arthralgies moins spécifiques imposant un bilan immunologique systématique chez une femme jeune.
Parmi les 11 critères définis par l’ACR, 4 suffisent à retenir le diagnostic (encadré 2 ). Ils sont surtout utiles pour les études cliniques. À l’échelle individuelle, on prend en compte la symptomatologie, les diagnostics différentiels éventuels et les résultats du bilan immunologique.
Cette hétérogénéité rend le diagnostic difficile, surtout quand les signes sont peu spécifiques (arthralgies, atteintes séreuses ou neurologiques).
Certains doivent alerter : lésions cutanées évocatrices, arthralgies moins spécifiques imposant un bilan immunologique systématique chez une femme jeune.
Parmi les 11 critères définis par l’ACR, 4 suffisent à retenir le diagnostic (
Évolution – pronostic
Les poussées se succèdent avec des intervalles libres de durée variable. Les périodes à risque sont le jeune âge, la grossesse. Une rémission survient souvent à la ménopause.
La pathologie est habituellement plus sévère chez l’enfant, les hommes et les sujets à peau noire.
Les glomérulonéphrites (stades III et IV) et les atteintes du système nerveux central sont les formes les plus graves et requièrent une immunosuppression.
L’éducation et l’information du patient, une bonne observance (hydroxychloroquine), l’éviction des facteurs favorisant les poussées sont essentiels à l’amélioration du pronostic.
Les complications des traitements sont à anticiper autant que faire se peut : rétinopathie sous hydroxychloroquine, infections et ostéoporose favorisées par les corticoïdes et les immuno- suppresseurs, risque néoplasique (hémopathies) induit.
La pathologie est habituellement plus sévère chez l’enfant, les hommes et les sujets à peau noire.
Les glomérulonéphrites (stades III et IV) et les atteintes du système nerveux central sont les formes les plus graves et requièrent une immunosuppression.
L’éducation et l’information du patient, une bonne observance (hydroxychloroquine), l’éviction des facteurs favorisant les poussées sont essentiels à l’amélioration du pronostic.
Les complications des traitements sont à anticiper autant que faire se peut : rétinopathie sous hydroxychloroquine, infections et ostéoporose favorisées par les corticoïdes et les immuno- suppresseurs, risque néoplasique (hémopathies) induit.
Prise en charge
Elle est symptomatique par les antalgiques et les AINS (avec prudence), une faible dose de prednisone contre les arthralgies modérées sans autres signes d’activité lupique, et les dermocorticoïdes locaux.
En traitement d’attaque (lupus actif) et en prévention des poussées, l’immunomodulation comporte une corticothérapie à doses variables selon l’atteinte, avec ou sans immunosuppresseur.
L’hydroxychloroquine (Plaquenil) est indispensable en thérapie de fond quelles que soient la forme et l’activité de la maladie, avec une surveillance ophtalmologique (commune aux antipaludéens de synthèse) et l’arrêt du tabac (qui diminue son efficacité).
En seconde ligne peuvent être proposés le méthotrexate contre l’atteinte articulaire et le thalidomide dans les formes cutanées.
Dans les troubles modérés cutanéo-articulaires, le bélimumab (Benlysta, anti-BAFF monoclonal) a récemment obtenu l’AMM en injection mensuelle intraveineuse. Il a une bonne efficacité en cas d’échec des traitements précédents, en particulier pour les atteintes articulaires et cutanées ; la prescription est pour le moment réservée aux spécialistes.
Les formes sévères justifient corticothérapie (Cortancyl) et immunosuppression d’emblée : notamment les glomérulonéphrites lupiques stades III et IV et les atteintes neurologiques centrales. Au cas pas cas et selon l’âge (surtout chez la femme), l’immunosuppresseur sera le mycophénolate mofétil (2 à 3 g/j) ou le cyclophosphamide intraveineux, et ce pendant 3 à 5 ans (durée non codifiée).
Un syndrome des antiphospholipides avec thrombose artérielle ou veineuse implique une anticoagulation définitive à dose curative.
En traitement d’attaque (lupus actif) et en prévention des poussées, l’immunomodulation comporte une corticothérapie à doses variables selon l’atteinte, avec ou sans immunosuppresseur.
L’hydroxychloroquine (Plaquenil) est indispensable en thérapie de fond quelles que soient la forme et l’activité de la maladie, avec une surveillance ophtalmologique (commune aux antipaludéens de synthèse) et l’arrêt du tabac (qui diminue son efficacité).
En seconde ligne peuvent être proposés le méthotrexate contre l’atteinte articulaire et le thalidomide dans les formes cutanées.
Dans les troubles modérés cutanéo-articulaires, le bélimumab (Benlysta, anti-BAFF monoclonal) a récemment obtenu l’AMM en injection mensuelle intraveineuse. Il a une bonne efficacité en cas d’échec des traitements précédents, en particulier pour les atteintes articulaires et cutanées ; la prescription est pour le moment réservée aux spécialistes.
Les formes sévères justifient corticothérapie (Cortancyl) et immunosuppression d’emblée : notamment les glomérulonéphrites lupiques stades III et IV et les atteintes neurologiques centrales. Au cas pas cas et selon l’âge (surtout chez la femme), l’immunosuppresseur sera le mycophénolate mofétil (2 à 3 g/j) ou le cyclophosphamide intraveineux, et ce pendant 3 à 5 ans (durée non codifiée).
Un syndrome des antiphospholipides avec thrombose artérielle ou veineuse implique une anticoagulation définitive à dose curative.
Mesures préventives
La lutte contre les complications réclame la mise à jour des vaccinations, la programmation des grossesses. L’aspirine à faible dose peut être utilisée en cas d’anticorps antiphospholipides persistants, même en l’absence d’événement thrombotique ou obstétrical.
La grossesse est autorisée si le lupus est quiescent depuis au moins 6 mois, avec un bilan initial comportant : complément, anticorps anti-ADN et antiphospholipides (aspirine en l’absence de complications obstétricales ou thrombotiques antérieures) et anticorps anti-SSA/SSB (si positifs : risque de lupus néonatal à surveiller par échographie cardiaque fœtale pour dépister bloc auriculo-ventriculaire et cardiomyopathie).
La maîtrise des risques liés au traitement est nécessaire : ostéoporose cortisonique (supplémentation vitamino-calcique et anti-ostéoporotique selon les recommandations), infections liées aux immunosuppresseurs (prévention antipneumocystose et herpès virus), atteinte rétinienne sous hydroxychloroquine, imposant un bilan ophtalmologique annuel (fond d’œil, champ visuel central et électrorétinogramme multifocal).
L’éducation et l’information portent sur les signes d’une poussée, l’observance (vérifiée par l’hydroxychloroquinémie), les facteurs déclenchants/favorisants : photoprotection +++, éviction des médicaments inducteurs, sevrage tabagique, contraception adaptée. Les estroprogestatifs sont contre-indiqués et on peut recourir aux microprogestatifs, aux moyens mécaniques ou au stérilet en l’absence d’immunosuppression sévère.
Enfin, la déclaration d’affection de longue durée (ALD 21) est indispensable.
La grossesse est autorisée si le lupus est quiescent depuis au moins 6 mois, avec un bilan initial comportant : complément, anticorps anti-ADN et antiphospholipides (aspirine en l’absence de complications obstétricales ou thrombotiques antérieures) et anticorps anti-SSA/SSB (si positifs : risque de lupus néonatal à surveiller par échographie cardiaque fœtale pour dépister bloc auriculo-ventriculaire et cardiomyopathie).
La maîtrise des risques liés au traitement est nécessaire : ostéoporose cortisonique (supplémentation vitamino-calcique et anti-ostéoporotique selon les recommandations), infections liées aux immunosuppresseurs (prévention antipneumocystose et herpès virus), atteinte rétinienne sous hydroxychloroquine, imposant un bilan ophtalmologique annuel (fond d’œil, champ visuel central et électrorétinogramme multifocal).
L’éducation et l’information portent sur les signes d’une poussée, l’observance (vérifiée par l’hydroxychloroquinémie), les facteurs déclenchants/favorisants : photoprotection +++, éviction des médicaments inducteurs, sevrage tabagique, contraception adaptée. Les estroprogestatifs sont contre-indiqués et on peut recourir aux microprogestatifs, aux moyens mécaniques ou au stérilet en l’absence d’immunosuppression sévère.
Enfin, la déclaration d’affection de longue durée (ALD 21) est indispensable.
*American College of Rheumatology.
Encadre
1. Molécules responsables de lupus érythémateux induits
• Isoniazide
Encadre
2. Critères du lupus érythémateux systémique (ACR* 1997)
Encadre
Perspectives thérapeutiques
Pour en savoir plus
– Fain O, Mekinian A. Critères diagnostiques, classification des atteintes et critères d’activité du lupus systémique. Rev Prat 2011;61:1259-60.
– Mathian A, Arnaud L, Amoura Z. Physiopathologie du lupus érythémateux systémique : le point en 2014. Rev Med Interne 2014;35:503-11.
– Mathian A, Arnaud L, Amoura Z. Prise en charge du lupus systémique. Rev Prat 2011;61:1263-70.
– Hello M, Senand R, Hamidou M. Lupus érythémateux systémique. Rev Prat Med Gen 2011;25:595-601.
– Mathian A, Arnaud L, Amoura Z. Physiopathologie du lupus érythémateux systémique : le point en 2014. Rev Med Interne 2014;35:503-11.
– Mathian A, Arnaud L, Amoura Z. Prise en charge du lupus systémique. Rev Prat 2011;61:1263-70.
– Hello M, Senand R, Hamidou M. Lupus érythémateux systémique. Rev Prat Med Gen 2011;25:595-601.

 Encadrés
Encadrés